a) 数々のレクチンの発見 [2]
最初にレクチンが発見されてから今日まで、数々のレクチンが発見されてきました。
科学では、たくさんの情報を獲得するようになると、”分類” が為されます。
また、分類といっても色々な方法があります。しかし、悪までも人間が決めるのですから、人間が研究するのに利用しやすいように分類するのが最善です。
まだ、発見されていないレクチンが多く存在しますが、多くのレクチンの一次構造が明らかにされているので、
どのレクチン分子が近縁であるかは客観的に判断できます。
また、ヒトをはじめとする多くの生物の全遺伝子構造が近い将来解読されようとしているこの時代においては、
レクチンもまずはタンパク質(遺伝子)ファミリーとして整理していくのがベストでしょう。
実際現在の主流となっている分類方法は糖鎖リガンドの情報を利用して分類されていますが、
この方法は分子クローニングによって明らかになったアミノ酸配列の相似性と進化論的な近似性により分類する方法です。
最初にこのようなクラス分類をしたのは Drickamer で、
彼は糖鎖結合ドメイン上の高度に保存されたアミノ酸配列モチーフに基づいてレクチンを 2 種類に大別しました。
一つのグループは、認識にカルシウムを必要とするので、C 型レクチンと名付けました。
もう一つのグループは、遊離のチオール基を必要とするので、S 型レクチンと名付けました。
一方、マンノース - 6 - リン酸を認識する二つのレクチンの配列が調べられ、両者の相同性が明らかになり、他のタイプのレクチンとは全く異なっていたため、
P 型レクチンと名付けられました。
b) レクチンファミリー [1]
a) で挙げられたレクチンファミリーの他にも、糖鎖リガンド別にファミリーとして分類されているものがあります。
以下に表 3.1 として示しましたのでご覧下さい。
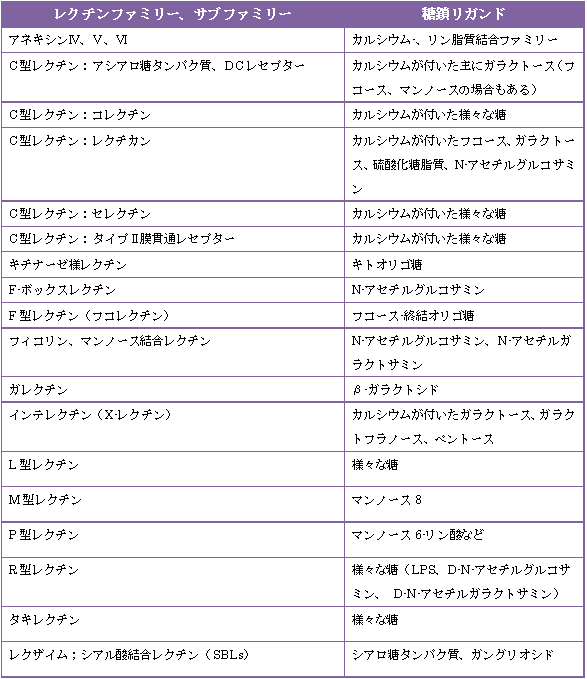
表 3.1 レクチンファミリーとそれぞれに対応する糖鎖リガンド (Glycome Informatics [1] 参照)
※アネキシン ・・・ リン脂質やカルシウムに結合する多機能タンパク質ファミリー
アシアロ糖タンパク質 ・・・ シアル酸を含む糖タンパク質からシアル酸を除去したもの
コレクチン ・・・ 生体防御レクチン
セレクチン ・・・ レクチン様ドメインをもつ細胞接着タンパク質の総称
フィコリン ・・・ 重合体構造をもつレクチン
ガレクチン ・・・ β-ガラクトシド特異的に結合する動物レクチン
タキレクチン ・・・ カブトガニからとれるレクチン
c) アネキシン
[4]

アネキシンはカルシウムおよびリン脂質に結合するタンパク質ファミリーです。
また、現在までに菌類を除くすべての真核細胞の植物および動物から 20 種類以上が見い出されています。
分子量は 30~40
kDa (アネキシン VI のみ約 66 kDa)のタンパク質で、構造上大きな特徴があります。
アミノ末端側ドメインはアネキシンそれぞれで固有の配列(11~196 残基)を持っています。
一方それに続くカルボキシ末端側のドメインは約 70 アミノ酸残基からなる
α ヘリックスが
4回(アネキシン VI のみ 8 回)繰り返した構造になっており、アネキシン間でよく保存されています。
また、カルシウム結合部位やリン脂質結合部位はカルボキシ末端側のドメイン上にあります。
ほとんどすべての種類の細胞がアネキシンファミリーのタンパク質を少なくとも1つは発現しており、
同時に複数のアネキシンを発現している細胞も多く、発現量も比較的多いのが特徴です。
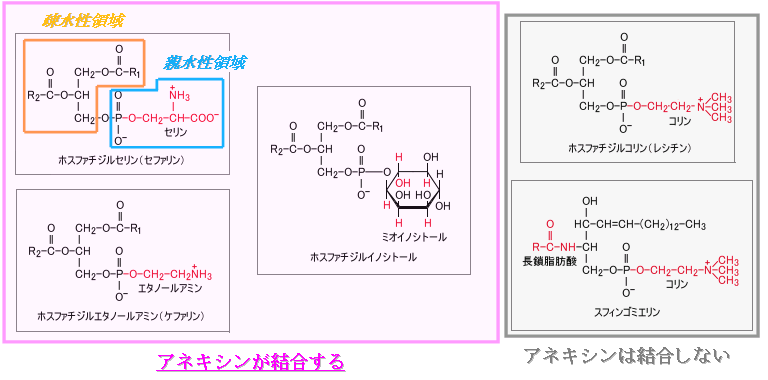
アネキシンはリン脂質の中でもホスファチジルセリン、ホスファチジルエタノールアミン、ホスファチジルイノシトールに結合します。
これらのリン脂質は細胞膜の内側に多く分布しており、正常な細胞表面にはほとんどありません。
一方、ホスファチジルコリン、スフィンゴミエリンは細胞表面に多いのですが、これらとはアネキシンは結合しません。
アネキシンが細胞内でその局在部位を変えることはよく観察されています(細胞質から細胞膜)。
つまり、アネキシンは
小胞輸送などのダイナミックな動きに対応しているのです。
※ 基質となるリン脂質を捕捉することによりホスホリパーゼ A2 の活性を抑制したり、
小胞輸送
、エンドサイトーシス、
エキソサイトーシスなどに関与して機能することが提唱されている。
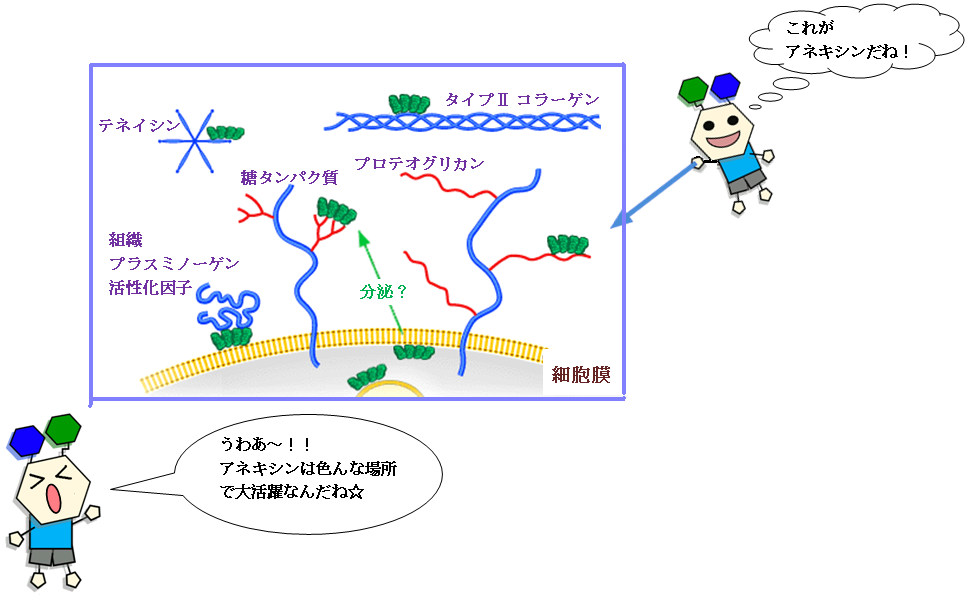
図 3.2 アネキシンの様々な役割 (GlycoWord [4] 参照)
細胞外スペースにおけるアネキシンへの推定リガンドの模式図。
アネキシンⅡは組織プラスミノーゲン活性化因子とテネイシン結合する。
d) C型レクチン
[4]
e) ガレクチン
[4]
ガレクチンファミリーとされる条件はガラクトースに対する結合特異性を有することと、ガレクチンファミリーを特徴づけるアミノ酸一次配列をもつことです。
また、一般には、可溶性で、金属要求性はありません。更には、細胞質タンパク質としての属性を示し、ジスルフィド結合、付加糖鎖、シグナル配列をもたず、
一般に N-末端アミノ酸はアセチル化されています。しかし、発現場所は細胞質内にとどまりません。
実際は核、細胞表面、細胞外マトリックスと多彩で、ガレクチン分子の種類、組織、時期によってしばしば異なります。
分泌機構に関しては不明な点が多く、シグナル配列を介さない新しいモデルが想定されています。
現在まで、ガレクチンは脊椎動物をはじめ、線虫、昆虫、海綿動物などの無脊椎動物にも広く分布することが知られていますが、
ガレクチンの関与する生命現象としては、発生、分化、形態形成、腫瘍転移、細胞死、
RNA スプライシングなど、多岐に及びます。
しかし、機能発現の機構、特に糖鎖認識との関連については未解決な部分がたくさん存在します。
現在までで報告されているガレクチンはその分子構築様式に基づいて、プロト、キメラ、直列反復型の三型に分類できます(図 3.4)。

図 3.4 ガレクチンの 3 つの構造のタイプ (GlycoWord [4] 参照)
←3-1
3-3→







